「ブライトパス・バイオ株式会社ってどんな会社?」
就職偏差値:Bランク
・がんワクチン/細胞医薬/抗体医薬に注力
・信州大学と固形がん CAR-T 細胞療法の共同研究開発契約を締結
会社業績

(引用)SBI証券
会社概要
| 設立 | 2003年5月8日 |
|---|---|
| 資本金 | 6,700百万円 |
| 従業員 | 38名 |
| 売上高 | 1500万円 |
事業区分
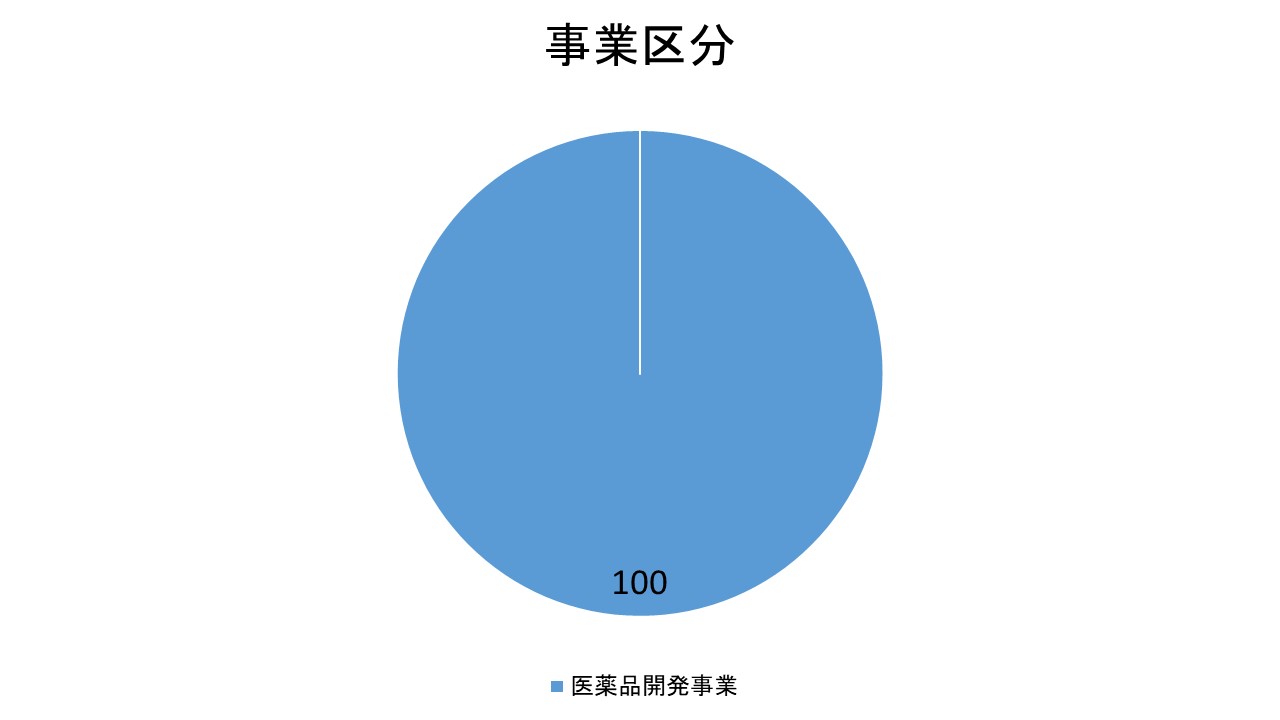
ブライトパス・バイオ株式会社は単一セグメントから成り立っています。
・医薬品開発事業
就活情報
平均年収:860万(平均年齢:53.1歳)
選考
詳細は公式HPよりご覧ください。
https://www.brightpathbio.com/recruit/index.html
☟適性検査の詳しい情報はコチラから!!☟
☟就活成功までの道のりはコチラから!!☟
事業詳細
医薬品開発事業
・新規がん免疫治療薬を自社創製もしくは導入し、探索研究から早期臨床試験までを手掛け、国内外の製薬会社に開発製造販売権をライセンスアウトし、ライセンス先からライセンス収入の取得を行っている。
事業TOPIX
◎有価証券報告書(2021/4~2022/3)
細胞医薬
・理化学研究所で創製されたiPS細胞由来再生NKT細胞療法(iPS-NKT)の第Ⅰ相医師主導治験が千葉大学で実施されており、当事業年度においても、着実に前進した。
・本治験を支援するとともに、次相臨床試験を見据えた製造工程改良に取り組んでいる。
・信州大学と共同開発を進めているHER2 CAR-T細胞療法(BP2301)は、当社において臨床試験に入る2つ目の細胞医薬プログラムとして、当事業年度中に準備をほぼ終え、2023年3月期の第1四半期中に信州大学にて第Ⅰ相医師主導治験を開始。
細胞医薬
・PD-1/PD-L1の次に来る有望な標的として、T細胞の疲弊や機能抑制に関する免疫チェックポイント分子*1もしくは免疫調整因子の機能を阻害する抗体の開発を進めている。
・抗CD73抗体(BP1200)、抗CD39抗体(BP1202)、抗TIM-3抗体(BP1210)、抗CD39抗体×抗TIM-3二重特異性抗体(BP1212)等で、早期ライセンスアウトを目指すための非臨床データの国際学会等での発表を順次進めた。
・2021年9月には、BP1200に関する2021年欧州臨床腫瘍学会年次会議(ESMO 2021)での発表が、優れた研究発表に贈られるベストポスター賞を受賞した。
がんワクチン
・完全個別化ネオアンチゲン・ワクチンをより強い抗腫瘍効果を発揮させるために免疫チェックポイント抗体によって送り届けるという新規プラットフォームBP1209の非臨床段階におけるコンセプト実証を達成した。
・米国で開発を進めてきたがんペプチドワクチンGRN-1201の非小細胞肺がんを対象とする免疫チェックポイント阻害抗体ペムブロリズマブとの併用第Ⅱ相臨床試験は、コロナ禍において患者登録が停滞し、当初目標とした当事業年度内の中間評価には至らなかった。
研究開発
研究開発TOPIX
iPS細胞由来再生NKT細胞療法(iPS-NKT)の開発
・2020年6月より世界でも初となるiPS細胞由来再生NKT細胞療法の医師主導治験が、頭頚部がんを対象として千葉大学医学部附属病院で進められている。
・2018年に、理化学研究所が進める本開発プロジェクトに参画し、共同研究を進めており、iPS-NKTの独占的開発製造販売ライセンスの導入オプション権を有している。
・本治験は順調に進んでおり、当社は医師主導治験を支援するとともに、次相企業治験を見据えた製造工程改良を進めている。
iHER2 CAR-T細胞療法(BP2301)の開発
・2022年5月6日付でHER2陽性の再発・進行骨・軟部肉腫及び婦人科悪性腫瘍を対象とする非ウイルス遺伝子改変HER2 CAR-T細胞の臨床第Ⅰ相医師主導治験が、信州大学医学部附属病院において開始された。
・数年間を予定する臨床第Ⅰ相医師主導治験で臨床上の安全性及び薬効が示唆された後は、企業治験となる第Ⅱ相臨床試験へ進む。
抗体医薬の開発
・ 抗CD73抗体(BP1200)、抗CD39抗体(BP1202)、抗TIM-3抗体(BP1210)について、先行品と差別化されたリード抗体を有し、担がんマウスモデルでの有効性を確認し、非臨床コンセプト証明に至る。
・非臨床試験を進めるとともに、まだ非臨床コンセプト証明に至っていない抗体をその段階へ到達させる。
がんワクチンの開発
免疫チェックポイント抗体連結個別化ネオアンチゲン・ワクチン(BP1209)
・抗腫瘍免疫を指令する樹状細胞に効率良くワクチン抗原を送達することによって、腫瘍抗原を標的とする細胞性免疫をBP1101よりもはるかに強力に惹起させることを、担がんマウスモデルで証明した。
がんペプチドワクチン(GRN-1201)
・2022年5月12日開催の取締役会で、米国で実施してきたGRN-1201の非小細胞肺がんを対象とする免疫チェックポイント抗PD-1抗体併用第Ⅱ相臨床試験(以下、「本試験」)を計画より早く切り上げることを決議した。
・治験対象と試験プロトコルで継続するよりも、評価項目、適格要件を再検討して、仕切り直す方が適切と判断した。
まとめ
1.久留米大学発創薬ベンチャー企業
2.がんワクチン/細胞医薬/抗体医薬に注力
3.信州大学と固形がん CAR-T 細胞療法の共同研究開発契約を締結
参照・引用
公式HP:https://www.brightpathbio.com/
就活生必見の記事
☟もっと企業研究をしたい方はコチラから!!☟