目次
「株式会社ジーエヌアイグループってどんな会社?」
就職偏差値:Bランク
・創薬ベンチャー企業
・中国の特発性肺線維症薬で高シェア
・米国で人工骨も展開
・中国の特発性肺線維症薬で高シェア
・米国で人工骨も展開
会社業績

(引用)SBI証券
・業績は右肩上がりに成長しており、今後にも期待できる。
会社概要
| 設立 | 2001年11月 |
|---|---|
| 資本金 | 75億1195万円 |
| 従業員 | 629名 |
| 売上高 | 126億9000万円 |
事業区分
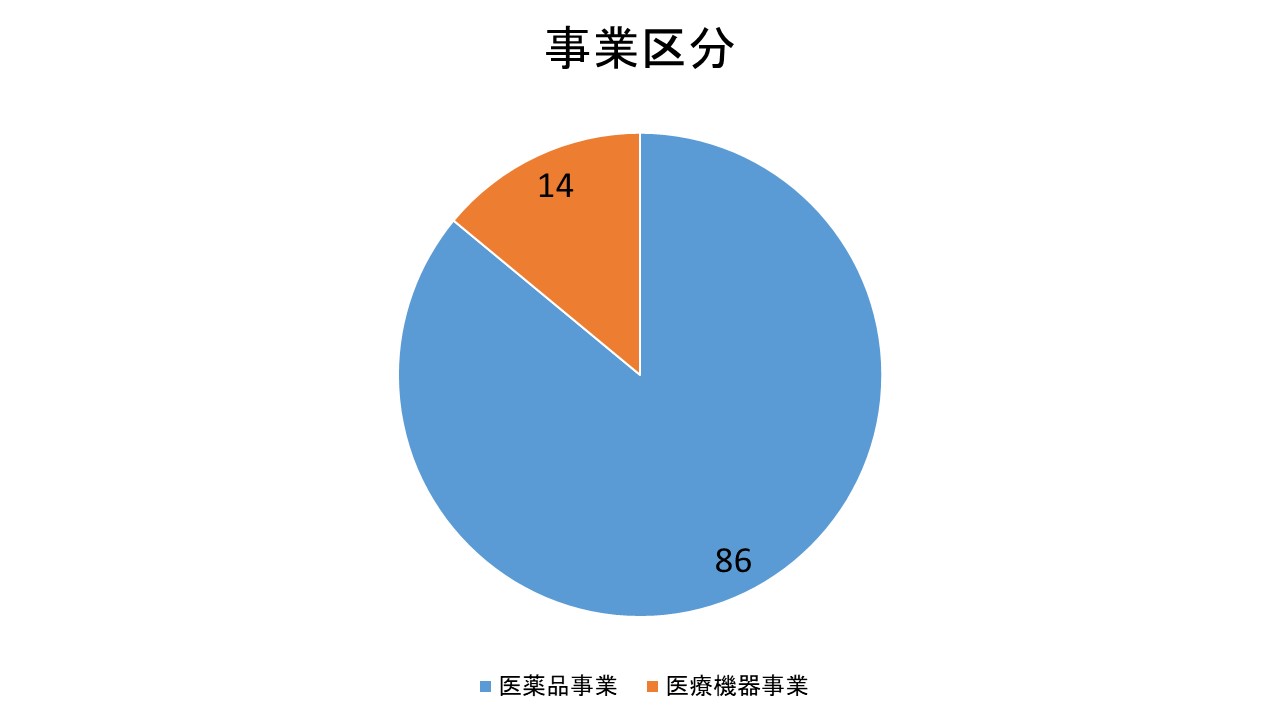
株式会社ジーエヌアイグループは主に2つのセグメントから成り立っています。
・医薬品事業
・医療機器事業
就活情報
平均年収:972万(平均年齢:53.1歳)
選考
現在新卒採用は行っておりません。
☟適性検査の詳しい情報はコチラから!!☟
☟就活成功までの道のりはコチラから!!☟
事業詳細
医薬品事業
・中国市場で販売しているアイスーリュイ及び臨床試験中のF351を主力とする開発化合物の研究開発・製造・販売を行っている。
事業TOPIX
◎有価証券報告書(2021/4~2022/3)
・医薬品の基幹製品であるアイスーリュイの中国での販売が引き続き好調に推移した。
・当連結会計年度の医薬品事業の売上収益とセグメント利益は、それぞれ10,895,082千円(前年同期比35.4%増)、983,070千円(前年同期比15.6%減)となった。
・セグメント利益の減少は、営業体制やマーケティング活動の強化、BCにおける生産設備の拡張によるもの。
医療機器事業
・米国を拠点とし医療機器(生体材料)の開発、製造及び販売を行っている。
事業TOPIX
◎有価証券報告書(2021/4~2022/3)
・米国におきましては、BABの医療機器事業(生体材料)が確固たる地位を築いており、新型コロナウイルス・パンデミックの2年に渡る影響の中でも、事業環境を改善し成長を達成することができた。
研究開発
研究開発TOPIX
◎2021年度
アイスーリュイ〔中国語:艾思瑞®、英語:ETUARY®(一般名:ピルフェニドン)〕
糖尿病腎症(DKD)
・アイスーリュイの3番目の適応症であるDKDは、Ⅰ型糖尿病またはⅡ型糖尿病により引き起こされる慢性腎臓病です。中国では9,240万人が糖尿病に脅かされており、このうち20~30%がⅠ型糖尿病またはⅡ型糖尿病を患い、腎機能障害を引き起こすと言われている。本第Ⅰ相臨床試験につきましては、2021年末時点で予備研究として24名の被験者が登録されている。
結合組織疾患を伴う間質性肺疾患(CTD-ILD)
・2016年9月、CTD-ILDの治療に対するアイスーリュイの4番目の適応症のNMPA承認を受けた。
・INDの承認により、全身性硬化症(強皮症、SSc-ILD)と皮膚筋炎(DM-ILD)の2つの適応症について、直接第Ⅲ相臨床試験に移行することが承認された。
・2018年6月には、強皮症(SSc-ILD)及びDM-ILDの治療を対象とした第Ⅲ相臨床試験の各段階において、無作為、二重盲検、プラセボ・コントロール、52週間の試験に第1期被験者を登録した。
・強皮症(SSc-ILD)には144名、DM-ILDには152名の被験者が登録される予定で、2021年末時点で、それぞれ15名、43名の被験者が登録されている。
じん肺治療薬(Pneumoconiosis Disease)
・2019年5月、アイスーリュイの5番目の適応症として、じん肺治療薬の治験許可(IND)申請に対する承認をNMPAより取得した。
・中国には、およそ43万3千人の患者様がおり、更に、適切な診断を受けていない患者様が、最大60万人いると推定されており、中国のみならず、世界中でアンメット・メディカル・ニーズ(有効な治療方法がない疾患に対する医療ニーズ)が存在します。当社グループは、病院との提携を進め、治験実施計画書を決定し、第Ⅲ相臨床試験を開始している。
F351(肝線維症等治療薬)
・中国、日本、豪州、カナダ、米国及び欧州各国を含む主要な国でのF351の特許権を保有している。
・2020年8月、当社は肝線維症の候補薬であるF351の中国における第Ⅱ相臨床試験の初期段階分析の良好な結果について発表した。中国における慢性ウイルス性B型肝炎患者の肝線維症に対するF351の安全性と有効性を評価する、無作為化、二重盲検、プラセボ・コントロール、多施設、用量逓増試験で、プラセボと比較して52週の治療で肝線維症スコアが統計的に有意に改善するという主要評価項目を満たした。
タミバロテン(急性前骨髄球性白血病(APL)治療薬)
・共同開発者の東光薬品工業株式会社および当社グループのGNI Hong Kong Limitedは、2015年10月に輸入医薬品としてタミバロテンをNMPAに登録申請いたしましたが、一旦却下された。
・NMPAは臨床試験の継続による再申請の可能性も示しておりますので、当社グループは中国での再申請に向け、今後の進め方を東光薬品工業株式会社と協議している。
F573(急性肝不全・慢性肝不全急性時(ACLF)治療薬)
・2020年9月に仁安病院より第Ⅰ相臨床試験実施の承認を受け、第Ⅰ相臨床試験において使用する人類遺伝子情報の届け出をHGRA(Human Genetics Resources Administration)に提出、受理され、2022年1月20日、第Ⅰ相臨床試験の最初の被験者への投与が行われた。
アイスーリュイ〔中国語:艾思瑞®、英語:ETUARY®(一般名:ピルフェニドン)〕
糖尿病腎症(DKD)
・アイスーリュイの3番目の適応症であるDKDは、Ⅰ型糖尿病またはⅡ型糖尿病により引き起こされる慢性腎臓病です。中国では9,240万人が糖尿病に脅かされており、このうち20~30%がⅠ型糖尿病またはⅡ型糖尿病を患い、腎機能障害を引き起こすと言われている。本第Ⅰ相臨床試験につきましては、2021年末時点で予備研究として24名の被験者が登録されている。
結合組織疾患を伴う間質性肺疾患(CTD-ILD)
・2016年9月、CTD-ILDの治療に対するアイスーリュイの4番目の適応症のNMPA承認を受けた。
・INDの承認により、全身性硬化症(強皮症、SSc-ILD)と皮膚筋炎(DM-ILD)の2つの適応症について、直接第Ⅲ相臨床試験に移行することが承認された。
・2018年6月には、強皮症(SSc-ILD)及びDM-ILDの治療を対象とした第Ⅲ相臨床試験の各段階において、無作為、二重盲検、プラセボ・コントロール、52週間の試験に第1期被験者を登録した。
・強皮症(SSc-ILD)には144名、DM-ILDには152名の被験者が登録される予定で、2021年末時点で、それぞれ15名、43名の被験者が登録されている。
じん肺治療薬(Pneumoconiosis Disease)
・2019年5月、アイスーリュイの5番目の適応症として、じん肺治療薬の治験許可(IND)申請に対する承認をNMPAより取得した。
・中国には、およそ43万3千人の患者様がおり、更に、適切な診断を受けていない患者様が、最大60万人いると推定されており、中国のみならず、世界中でアンメット・メディカル・ニーズ(有効な治療方法がない疾患に対する医療ニーズ)が存在します。当社グループは、病院との提携を進め、治験実施計画書を決定し、第Ⅲ相臨床試験を開始している。
F351(肝線維症等治療薬)
・中国、日本、豪州、カナダ、米国及び欧州各国を含む主要な国でのF351の特許権を保有している。
・2020年8月、当社は肝線維症の候補薬であるF351の中国における第Ⅱ相臨床試験の初期段階分析の良好な結果について発表した。中国における慢性ウイルス性B型肝炎患者の肝線維症に対するF351の安全性と有効性を評価する、無作為化、二重盲検、プラセボ・コントロール、多施設、用量逓増試験で、プラセボと比較して52週の治療で肝線維症スコアが統計的に有意に改善するという主要評価項目を満たした。
タミバロテン(急性前骨髄球性白血病(APL)治療薬)
・共同開発者の東光薬品工業株式会社および当社グループのGNI Hong Kong Limitedは、2015年10月に輸入医薬品としてタミバロテンをNMPAに登録申請いたしましたが、一旦却下された。
・NMPAは臨床試験の継続による再申請の可能性も示しておりますので、当社グループは中国での再申請に向け、今後の進め方を東光薬品工業株式会社と協議している。
F573(急性肝不全・慢性肝不全急性時(ACLF)治療薬)
・2020年9月に仁安病院より第Ⅰ相臨床試験実施の承認を受け、第Ⅰ相臨床試験において使用する人類遺伝子情報の届け出をHGRA(Human Genetics Resources Administration)に提出、受理され、2022年1月20日、第Ⅰ相臨床試験の最初の被験者への投与が行われた。
まとめ
1.創薬ベンチャー企業
2.中国の特発性肺線維症薬で高シェア
3.米国で人工骨も展開
参照・引用
公式HP:https://www.gnipharma.com/
就活生必見の記事
☟もっと企業研究をしたい方はコチラから!!☟